Kako pronaći volumen plina?

Prije rješavanja problema, potrebno je razmotriti formule iPravila kako pronaći volumen plina. Treba imati na umu zakon Avogadro. I sam volumen plina može se izračunati pomoću nekoliko formula, odabirajući od njih prikladan. Prilikom odabira potrebne formule, okolišni uvjeti, osobito temperatura i tlak, od velike su važnosti.
Avogadrojev zakon
On kaže da je pod istim pritiskom iiste temperature, u istoj količini različitih plinova, sadržavat će isti broj molekula. Broj molekula plina koji se nalaze u jednoj molu je Avogadro broj. Iz ovog zakona slijedi da: 1 kmol idealnog plina i bilo kojeg drugog, istog tlaka i temperature (760 mm Hg i t = 0 * C) zauzimaju uvijek jedan volumen = 22,4136 m3.
Kako odrediti volumen plina
- Najčešće se nalazi u formuli V = n * Vmproblemi. Ovdje, volumen plina u litrama - V, VIII - molarni volumen plina (l / mol), koji je pod normalnim uvjetima = 22.4 l / mol, i n - količina tvari mola. Kada u uvjetima nema količine tvari, ali postoji mase tvari, tada nastavljamo na sljedeći način: n = m / M. Ovdje M je g / mol (molarna masa tvari), a masa tvari u gramima je m. U periodičnom je stihu napisana pod svaki element, kao njegova atomska masa. Dodamo sve mase i dobijemo potrebnu.
- Dakle, kako izračunati volumen plina. Evo problema: otopite 10 grama aluminija u klorovodičnoj kiselini. Pitanje: koliko se vodik može isticati kada n. g.? Reakcijska jednadžba je sljedeća: 2Al + 6HCl (g) = 2AlCl3 + 3H2. Na samom početku nalazimo aluminij (količina), reagiraju prema formuli: n (Al) = m (Al) / M (Al). Uzimamo masu aluminija (molarni) iz Mendelejevog stola M (Al) = 27 g / mol. Zamjenjujemo: n (Al) = 10/27 = 0,37 mol. Iz kemijske jednadžbe jasno je da se 3 molova vodika formira kada se dva mola aluminija otopi. Treba se izračunati i koliko će vodik biti oslobođen od 0,4 mola aluminija: n (H2) = 3 * 0,37 / 2 = 0,56 mola. Zamijenili smo podatke u formuli i pronašli volumen ovog plina. V = n * Vm = 0,56 * 22,4 = 12,54L.
Pročitajte više:

Kako pronaći volumen piramide?

Kako pronaći volumen lopte?

Kako pronaći volumen cilindra?

Kako pronaći volumen kocke?

Kako pronaći gustoću?

Kako se mijenja pritisak idealnog plina?

Kako pronaći masu kroz volumen?
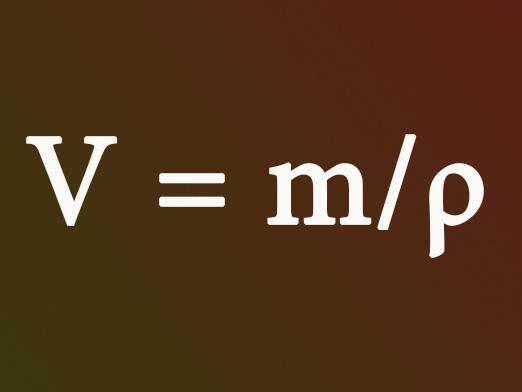
Kako pronaći volumen kroz masu?
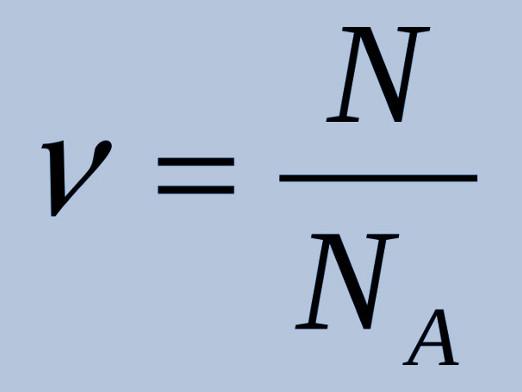
Kako pronaći količinu tvari?

Kako pronaći volumen konusa?